神経発生ー小脳発生・神経回路形成
ゼブラフィッシュ小脳における顆粒細胞・プルキンエ細胞の遺伝子発現プロファイリング [Pubmed]
小脳は運動の制御や学習の制御に関わり、その神経回路は魚類から哺乳類まで保存されています。小脳では、顆粒細胞とプルキンエ細胞に対して苔状線維と登上線維からの情報が入力し、2つの情報がプルキンエ細胞で統合され、投射神経により出力されます。本研究では、小脳ニューロン形態形成の分子基盤を明らかにするために、遺伝子プロファイリング解析を行いました。小脳神経回路を構成する顆粒細胞、プルキンエ細胞、投射神経、下オリーブ核ニューロン、Bergmannグリア細胞にGal4あるいは蛍光タンパク質を発現するトランスジェニックゼブラフィッシュを用いて、各々の細胞系列をFACSにより単離し、RNA sequencingを行いました。この結果をもとに、細胞系列間で遺伝子発現量を比較検討し、各々の細胞特異的に発現する遺伝子を同定しました。顆粒細胞に高く発現する遺伝子群について性質を調べると、細胞の発生に関わるものが多く、プルキンエ細胞においては、神経細胞の機能に関わる遺伝子が多く存在していました。また、顆粒細胞やプルキンエ細胞に特異的に発現する遺伝子のうち、いくつかで小脳類似の細胞・回路を持つ小脳様構造にも発現していたことから、小脳様構造においても共通の分子機構があることを示唆されました。本研究の結果は、ゼブラフィッシュにおける小脳神経回路の発生や機能、さらに脊椎動物の小脳神経回路の進化を理解する上で有用な情報になると考えられます。
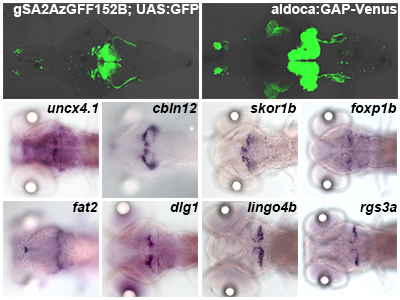
小脳ニューロンの遺伝子プロファイリング解析。小脳神経回路に蛍光タンパク質を発現するトランスジェニックゼブラフィッシュ(A,B)を用いて、FACSにより各々の系列の細胞を単離した。細胞からRNAを抽出し、RNA sequencingを行い、顆粒細胞・プルキンエ細胞に特異的に発現する遺伝子を同定した。同定した遺伝子についてin situ hybridizationにより発現解析を行った。(C-F)顆粒細胞、(G-J)プルキンエ細胞特異的に発現する遺伝子群の発現を示した。
ゼブラフィッシュにおいてIV型コラーゲンは基底膜の整合性を保つことで小脳顆粒細胞の軸索形成を制御している [Pubmed]
顆粒細胞は小脳の主要なグルタミン作動性神経であり、顆粒細胞の軸索形成は小脳神経回路形成の最初のステップです。 ゼブラフィッシュの小脳においては、顆粒細胞は、細胞体の位置により前方内側と後方外側の二つのグループに分けることができます。 後方外側の顆粒細胞の軸索は、小脳内でプルキンエ細胞とシナプスを形成した後、背側後脳に存在するクレスト細胞に軸索を投射します。 ゼブラフィッシュ変異体shiomanekiにおいては、後方外側の顆粒細胞の軸索の走行異常を示します。 私達は、ポジショナルクローニング法により、shiomaneki遺伝子座が基底膜の構成要素であるIV型コラーゲンCol4a6をコードすることを見出しました。 Col4a6とCol4a5は三量体を構成することが知られていますが、col4a5およびcol4a6両変異体において顆粒細胞と網膜神経節細胞の軸索に関して類似の形成異常が認められました。 これまで、IV型コラーゲンは軸索ガイダンス分子Slitの濃度勾配を調節することで軸索形成を制御するという説が提唱されてきたが、Slitを過剰発現しても顆粒細胞軸索に影響を与えませんでした。 col4a5およびcol4a6変異体では、軸索が走行する視蓋や背側後脳を囲う基底膜の構造異常が認められ、この異常に連動して軸索の走行異常が生じていました。 顆粒細胞の軸索は、実験的に切断した後再生しますが、col4a6変異体においては元の軸索と再生軸索が類似の走行異常を示しました。 以上の結果は、IV型コラーゲンは基底膜の整合性を保つことで、顆粒細胞の軸索形成を制御していること、基底膜は顆粒細胞の軸索に標的に導くための正しい経路を提供していることを示しています。 これらの知見は、ヒトのIV型コラーゲン変異の遺伝病であるアルポート症候群の病態解明に役立つ可能性があります。
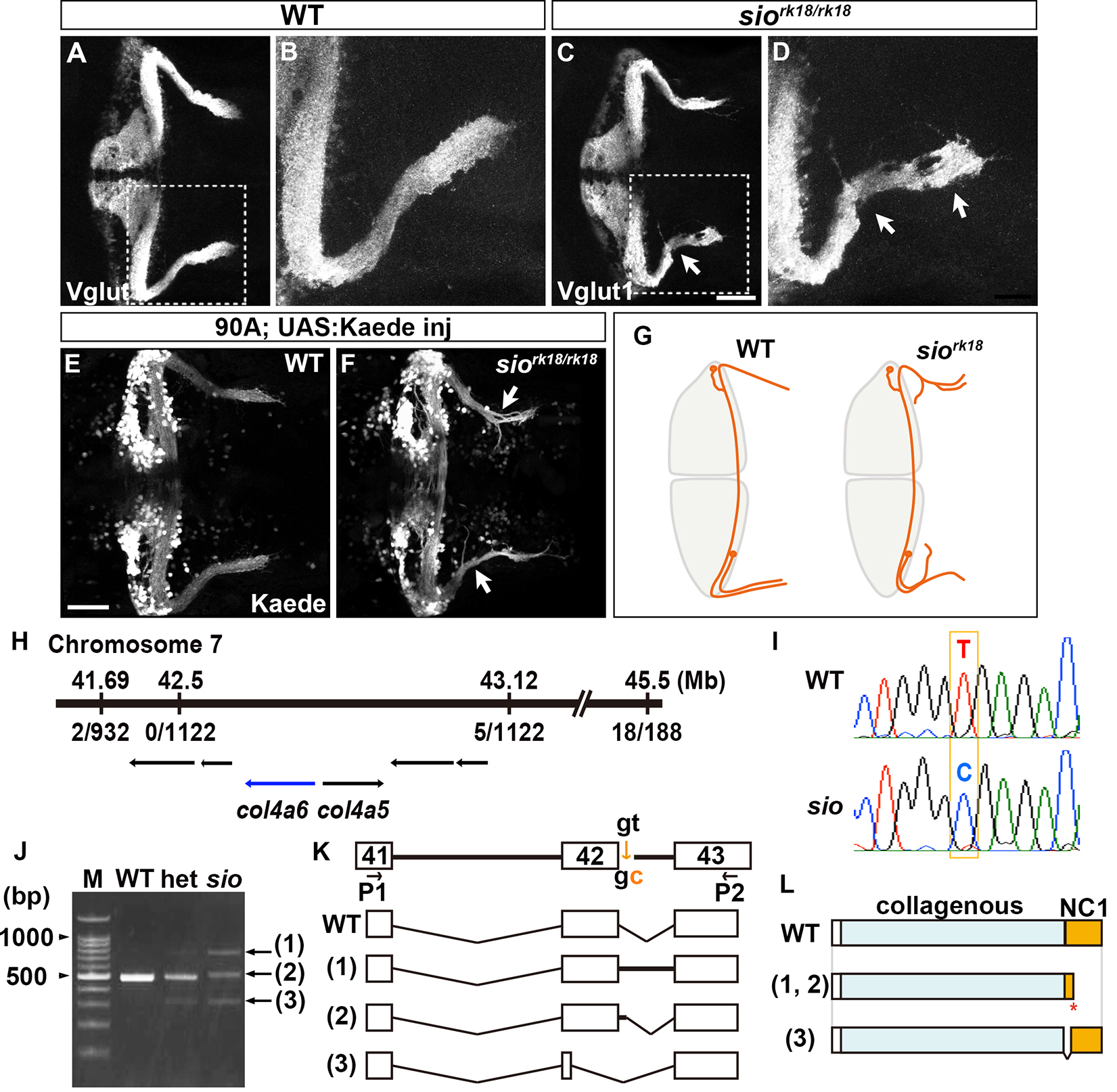
IV型コラーゲン遺伝子col4a6は小脳後方外側の顆粒細胞の軸索形成に必要である。 (A-D)野生型(WT)とshiomaneki変異体(siork18/rk18)の受精後5日目の稚魚を、顆粒細胞の軸索マーカーであるVglut1抗体で染色したもの(小脳背側像)。 (E, F)小脳顆粒細胞を顆粒細胞特異的Gal4系統で可視化した像。 (G)野生型とshiomaneki変異体の顆粒細胞軸索走行の模式図。 shiomaneki変異体では、小脳後方外側の顆粒細胞の軸索走行に異常を示す。 (H-L)shiomaneki変異体の責任遺伝子はcol4a6遺伝子である。 shiomaneki変異体では、42番目のエキソンの3’側のスプラインシングドナーに変異があり正常なスプライシングが起きず、C末端を欠損したタンパク質をコードしている。
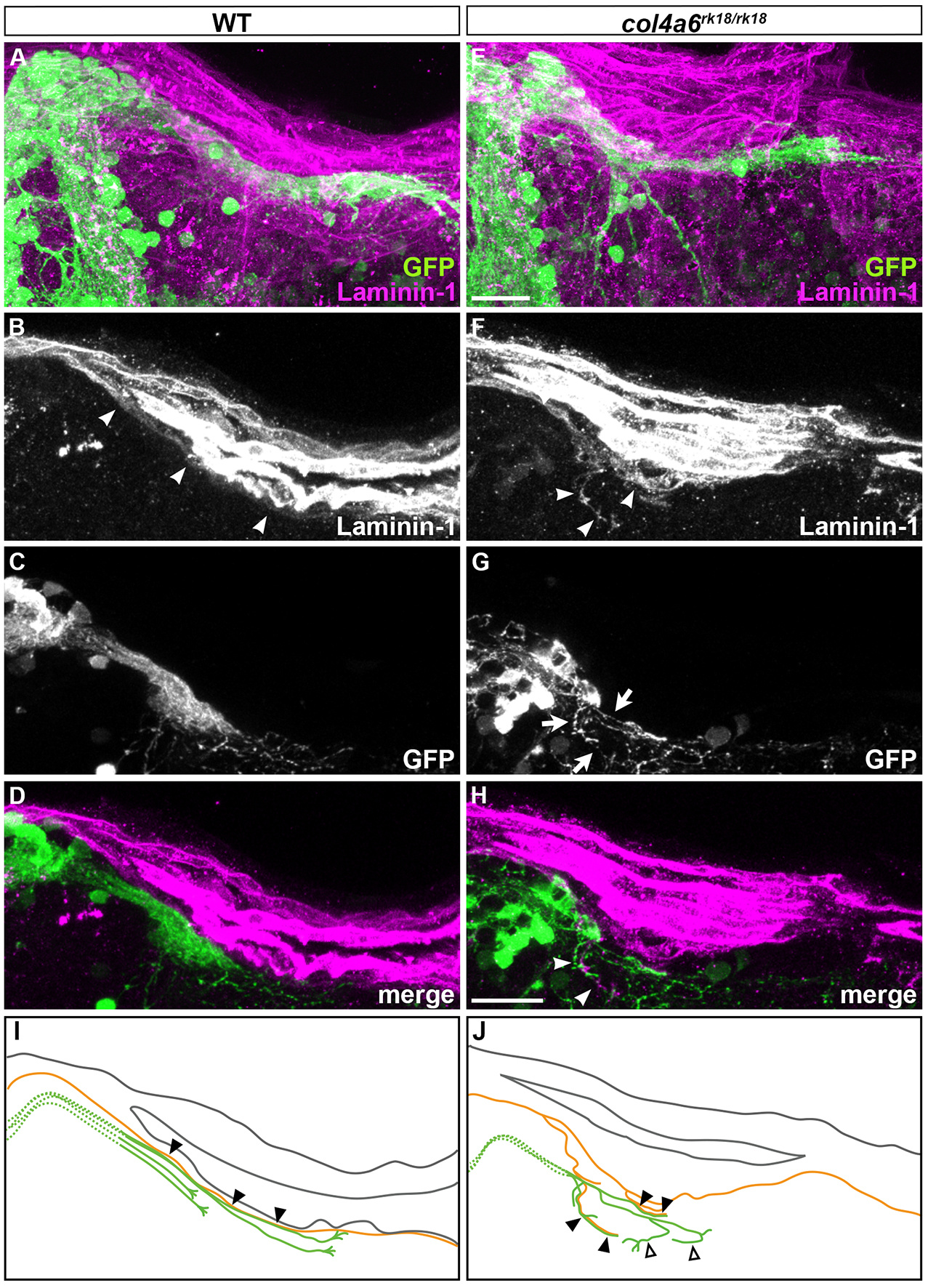
col4a6変異体において基底膜異常と顆粒細胞軸索走行異常は連動している。 (A-H)野生型およびcol4a6変異体(shiomaneki変異体)の、基底膜をLaminin-1抗体で、顆粒細胞軸索を顆粒細胞特異的Gal4系統を用いて可視化(GFP)している。 背側後脳の背側像。(I, J)抗体染色の結果を模式図で示している。 col4a6変異体においては、基底膜が分離している部分があり、同じ場所で顆粒細胞の軸索束も分枝し、異常な基底膜に並走する形で走行異常を示している。
小脳神経回路の発生過程の解析のためのGal4ゼブラフィッシュトランスジェニック系統の樹立 [Pubmed]
小脳は、協調運動の制御や運動学習に関与しています。私達は、Tol2トランスポゾンを用いて、小脳神経回路の構成要素である顆粒細胞、プルキンエ細胞、投射神経(広樹状突起細胞)、バーグマングリア、(登上線維をプルキンエ細胞へ送る)下オリーブ核ニューロンに、改変型Gal4-VP16(GFF)を発現するトランスジェニックゼブラフィッシュ系統を単離しました。これらGal4系統とGal4結合配列(UAS)の下流にレポーター遺伝子をもったトランスジェニックフィッシュを交配させ、小脳神経回路の構造と発生過程の解析を行いました。下オリーブ核特異的Gal4系統と、光変換型タンパク質KaedeをUASの下流に持ったレポーター系統と交配し解析した結果、登上線維の反対性の軸索投射(例、左の下オリーブ核は右のプルキンエ細胞に投射)を確認しました。顆粒細胞特異的Gal4系統と神経軸索トレーサーWGA(小麦胚芽レクチン)をUAS下流で発現するレポーター系統を交配し解析し、顆粒細胞とプルキンエ細胞、広樹状突起細胞、下オリーブ核との神経結合をゼブラフィッシュで確認しました。さらに、顆粒細胞特異的Gal4系統を用いて経時的観察を行った結果、顆粒細胞の細胞体は最初ランダムに運動した後、腹側へ移動することを見出した。また、樹立したGal4系統とTol1トランスポゾンを用いたレポーター遺伝子の導入により、ニューロンの構造を一細胞レベルで観察することができました。これらの解析結果は、これらゼブラフィッシュGal4系統が小脳神経回路の発生と機能を研究するために有用であることを示しています。
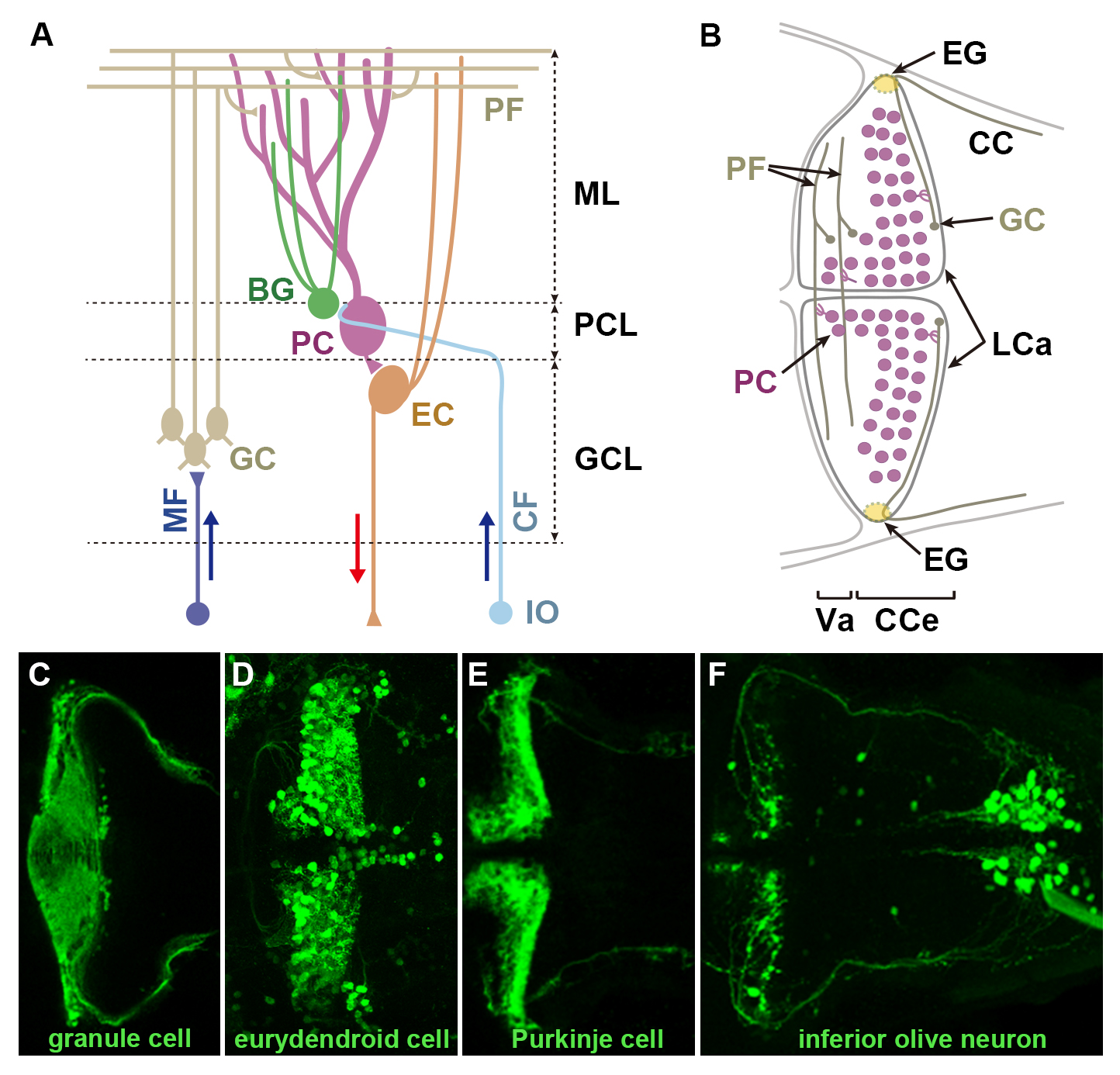
(A)ゼブラフィッシュ小脳神経回路の模式図。(B)ゼブラフィッシュ小脳領域の背側像模式図。顆粒細胞特異的Gal4 系統(C)、広樹状突起細胞特異的Gal4 系統(D)、プルキンエ細胞特異的GAP-Venus系統(E)、下オリーブ核ニューロン特異的Gal4 系統(F)。C,D,Fに関しては、UAS:GFPレポーター系統と交配している。受精後5日目の稚魚、背側像。BG:バーグマングリア、CC:小脳陵、CCe:小脳体、CF:登上線維、EC:広樹状突起細胞、GC:顆粒細胞、GCL:顆粒細胞層、IO:下オリーブ核、LCa:小脳尾葉、ML:分子層、PC:プルキンエ細胞、PCL:プルキンエ細胞層、PF:平行線維、Va:小脳弁。
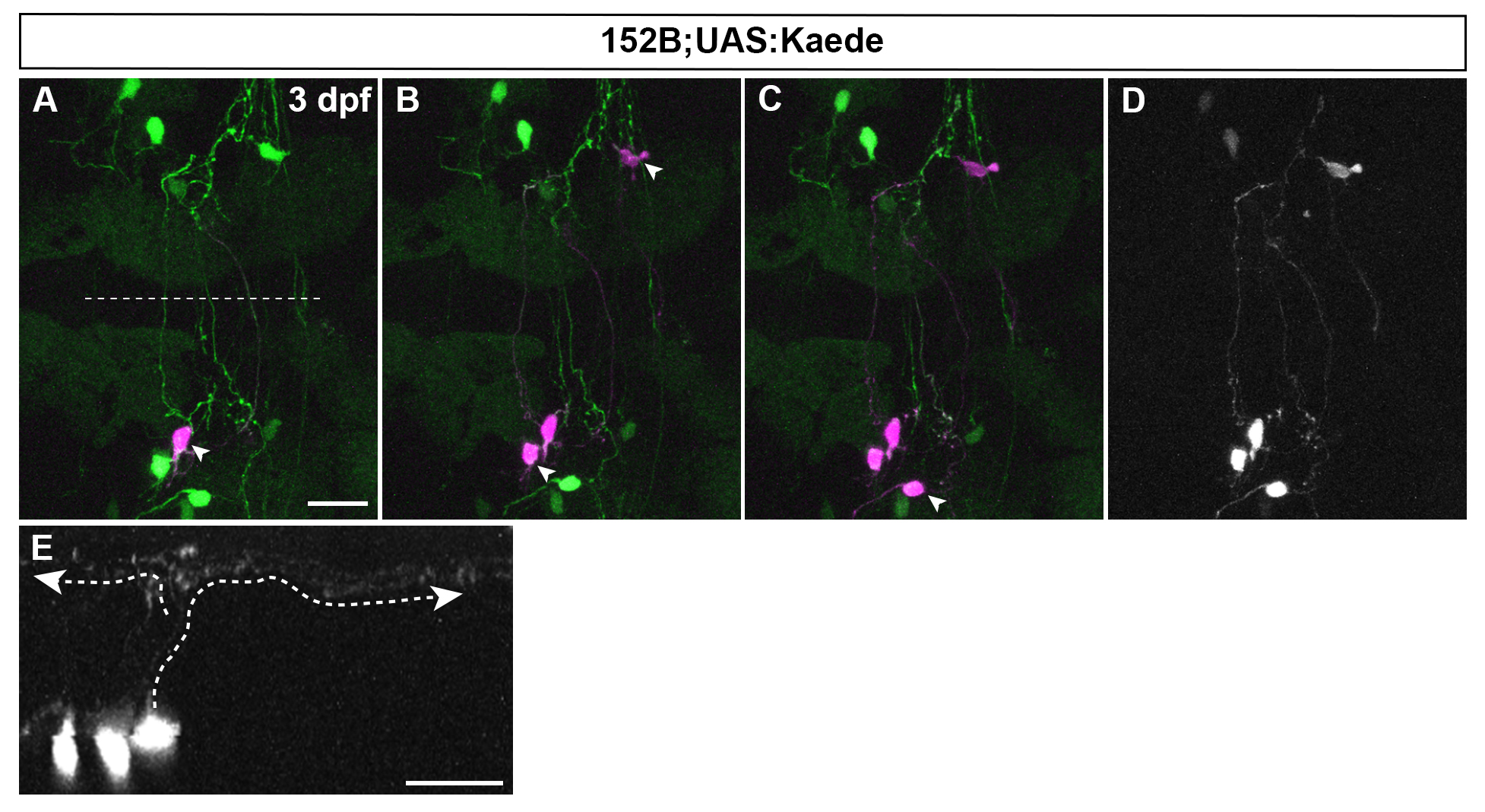
顆粒細胞特異的Gal4系統gSA2AzGFF152B系統とモザイクUAS:Kaede系統と交配して得られた受精後3日目の仔魚の小脳領域。背側像(A−C)。顆粒細胞の細胞体にレーザーを照射し標識している(レーザー未照射および照射後のKaedeを、それぞれ緑を紫で表示)。1細胞体(A)、3細胞体(B)、4細胞体(C)を標識。変換したKaedeのイメージ:背側像(D)、横断面像(E)。
非定型プロテインキナーゼCはゴルジ装置の局在を介して一次樹状突起の分化を制御している [Pubmed]
ニューロンは非常に極性を持った構造を持っており、細胞体のどの部分から軸策や樹状突起を伸長するかを決めています。しかし、どのようなメカニズムでニューロンの極性が決まっているかは殆ど分かっていません。小脳のプルキニエ細胞は、細胞体から一本の一次樹状突起を伸ばしており、それが分枝することで複雑は樹状突起構造を作っています。私達は、ゼブラフィッシュの小脳を用いてプルキニエ細胞が極性を獲得するメカニズムを解析しました。まず、個々のプルキニエ細胞の樹状突起の形成過程を検索するため、プルキニエ細胞特異的プロモーターを用いて細胞膜結合型蛍光タンパク質を発現させ細胞の形態を観察しました。プルキニエ細胞は最初複数の神経突起を細胞体から伸ばしていますが、その内一つを残して神経突起を退縮させます。残った突起が一次樹状突起になることを見出しました。さらに、ゴルジ装置は一次樹状突起の根元に特異的に局在し、その局在は神経突起を複数有する未熟なプルキニエ細胞においてすでに確立していました。ゴルジ装置を介したタンパク質分泌経路を阻害すると樹状突起の伸長が阻害されることから、ゴルジ装置が樹状突起形成に関与していることが示唆された。非定型プロテインキナーゼCであるPrkciの変異体においては、プルキニエ細胞は複数の一次樹状突起を有しており、ゴルジ装置の局在に異常が認められました。さらに、プルキニエ細胞でPrkciの機能を阻害した場合も、Prkci欠損変異体と同様のプルキニエ細胞の表現型が認めらました。これらの結果は、非定型プロテインキナーゼCが細胞自律的にゴルジ装置の局在をコントロールすることで、プルキニエ細胞の一次樹状突起の分化を制御していることを示しています。
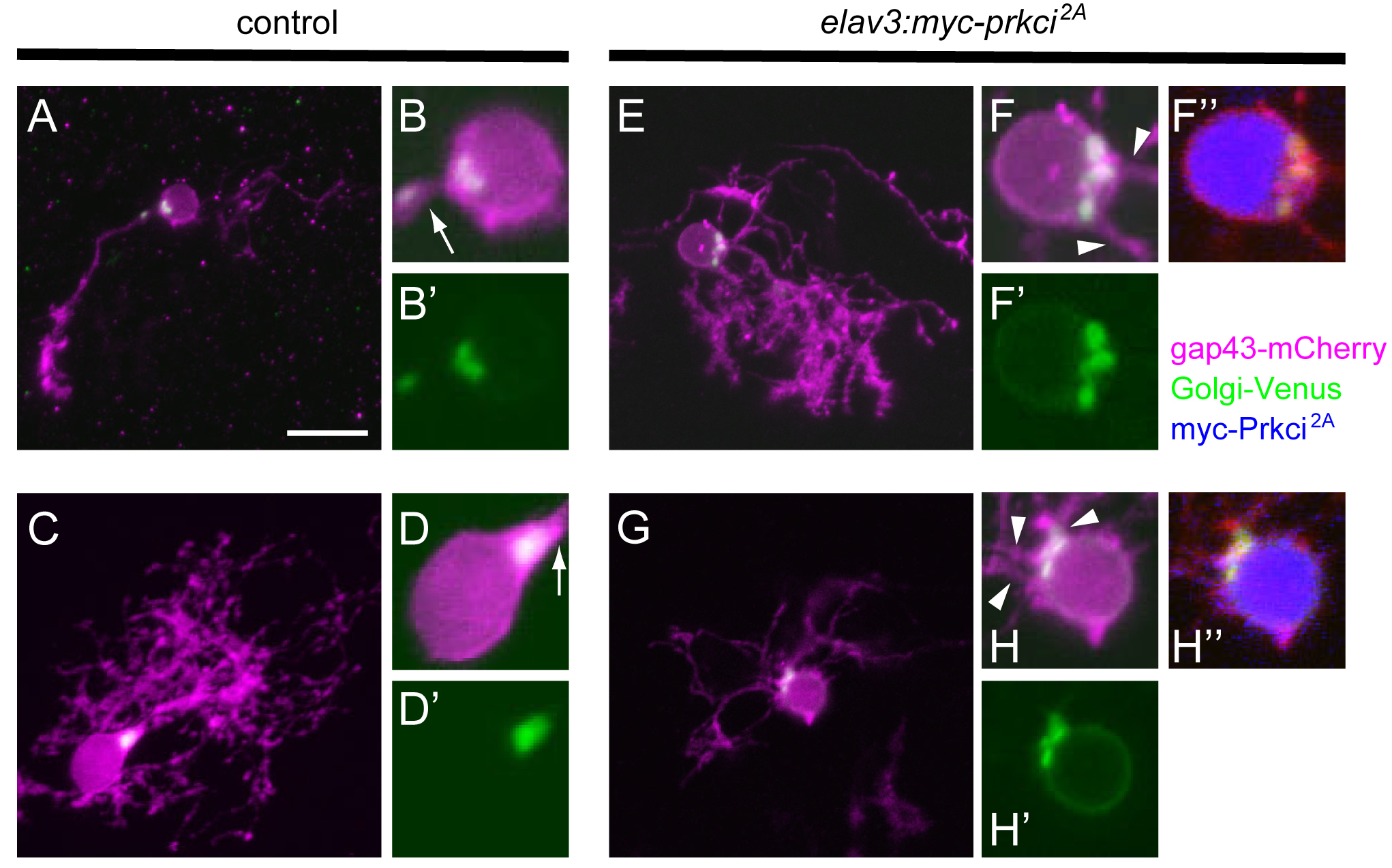
Prkciはプルキニエ細胞においてゴルジ装置の局在および一次樹状突起の選択に必要である。プルキニエ細胞特異的プロモーター(aldoca)により膜結合型mCherry(gap43-mCherry、紫)とゴルジ装置局在型Venus(Golgi-Venus緑)を発現させた受精後5日目のプルキニエ細胞。(E-G)はドミナントネガティブPrkci(Myc-Prkci2A、青)を発現させた細胞で、(A-D)はMyc-Prkci2Aを発現していないコントロールプルキニエ細胞。(B, B’, D, D’, F, F’, F’’, H, H’, H’’)細胞体近傍の強拡大像。コントロールのプルキニエ細胞では一本の一次樹状突起を伸長させており(矢印)、ゴルジ装置は一次樹状突起の根元に存在する。一方ドミナントネガティブPrkciを発現させたプルキニエ細胞は複数の一次樹状突起を持っており、ゴルジ装置の領域が拡大していた。また、増えた一次樹状突起は、拡大したゴルジ装置の近傍から伸長していた(矢じり)。
ジンクフィンガー遺伝子Fezf1とFezf2は、前脳でHes5遺伝子の発現を抑制することで神経分化を制御している [Pubmed]
正確な神経分化の制御は、前脳での多様な神経細胞を形成するために必須です。 しかし、これまで前脳で神経分化を開始させる転写カスケードに関しては、殆ど明らかとなっていませんでした。 本研究では、転写抑制因子をコードするジンクフィンガー遺伝子Fezf1とFezf2が、前脳初期の神経幹細胞に発現しており、マウスの背側終脳の神経形成を制御することを見出しました。 Fezf1, Fezf2欠損マウスの前脳ではHes5の発現が増加し、Hes5によって発現が抑制されるneurogenin2の発現が減少していました。 FEZF1、FEZF2タンパク質ともHes5のプロモーターに結合し、その活性を抑制することを見出しました。 Fezf1, Fezf2欠損マウスの前脳では、神経幹細胞から、早期に生まれる大脳皮質ニューロンや中間神経前駆細胞への分化が抑制されていました。 Hes5遺伝子を欠損させることで、Fezf1, Fezf2欠損前脳に見られる神経形成の異常が抑制されました。 これらの結果は、Fezf1とFezf2が、Hes5の発現を抑制することでneurogenin2の発現を脱抑制し、神経幹細胞の分化を促進することを明らかにしました。
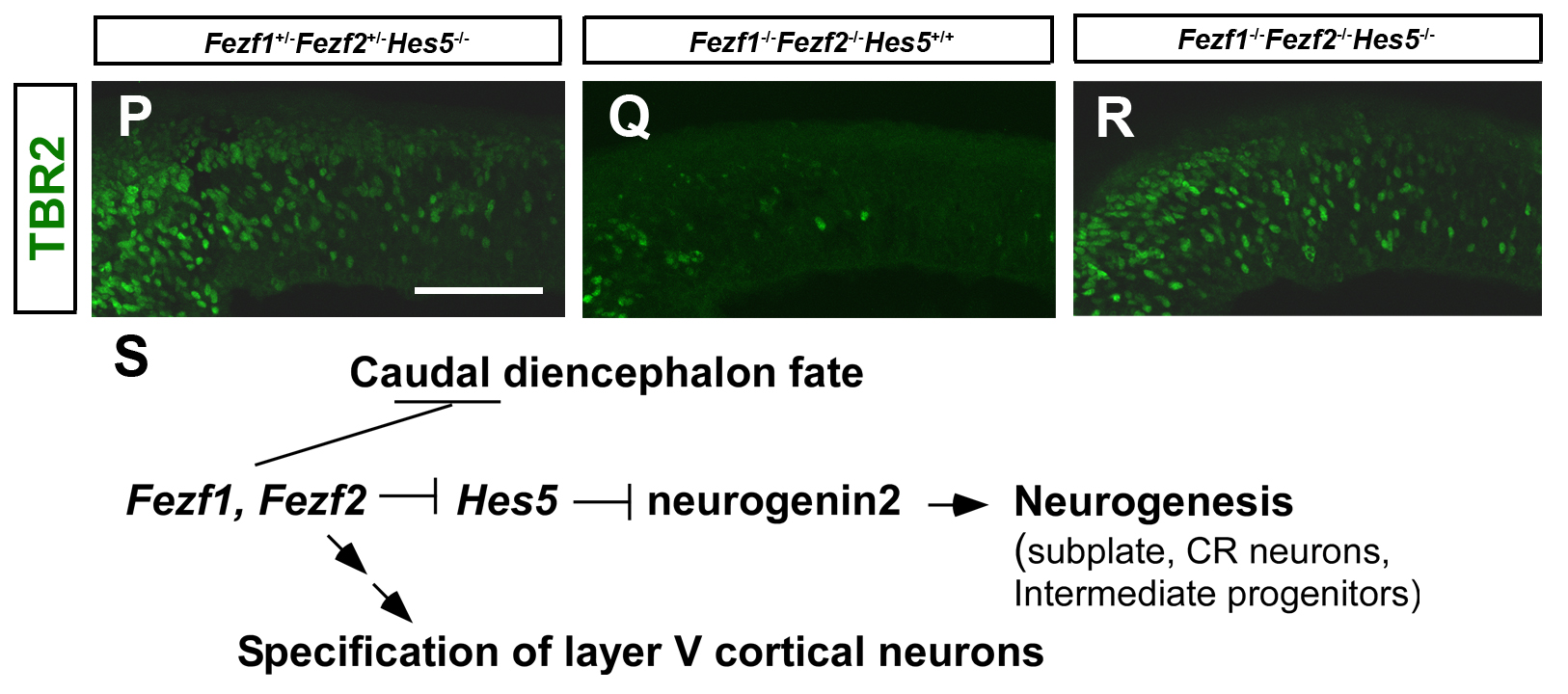
Fezf1, Fezf2欠損マウスの前脳(Q)では、神経幹細胞からのTBR2陽性の中間神経前駆細胞の分化が抑制されているが、 Fezf1, Fezf2, Hes5欠損マウス(R)では中間神経前駆細胞の形成が回復している(上断)。 Fezf1とFezf2を介した前脳形成機構(下段)。 Fezf1とFezf2は、Hes5を抑制することでneurogenin2を脱抑制し、神経分化を誘導する。 加えて、Fezf1とFezf2は前脳の前後軸形成を制御すること、Fezf2は大脳皮質5層の投射神経の形成に関与していること、が知られている。
ゼブラフィッシュ小脳におけるプロニューラル遺伝子に関連した神経発生 [Pubmed]
哺乳類において、小脳ニューロンはグルタミン酸作動性神経とGABA作動性神経に分類され、それぞれ、プロニューラル遺伝子atoh1とptf1aが発現する神経前駆細胞に由来します。 ゼブラフィッシュにおいては、atoh1a, atoh1b, atoh1cの三つのatoh1遺伝子が存在し上菱脳唇(URL)の重複したドメインに発現するのに対し、ptf1aは脳室帯(VZ)に限局して発現します。 本研究では、atoh1aおよびptf1aの遺伝子発現制御領域依存性に蛍光タンパク質を発現するトランスジェニックフィッシュを用いて、小脳ニューロンの細胞系譜を追跡しました。 atoh1a陽性神経前駆細胞からは、顆粒細胞だけでなく、小脳腹側に位置するニューロンも産生されることを見出しました。 また、ptf1a陽性神経前駆細胞からはプルキニエ細胞が産生されることも見出しました。 グルタミン酸作動性olig2陽性eurydendroid細胞(小脳外に情報を送る投射神経)の多くは、VZに存在するptf1a陽性前駆細胞から産生されますが、一部はURLに位置するatoh1陽性前駆細胞からも産生されました。 成体小脳では、atoh1a, atoh1b, atoh1cは、小脳弁および小脳体の正中線周辺部の分子層で発現し、ptf1aはVZに発現が認められました。 これらのプロニューラル遺伝子の発現は、成体小脳において増殖している神経前駆細胞に一致していました。 これらのデータは、小脳におけるプロニューラル遺伝子に関連した神経発生は脊椎動物間で進化的に保存されていること、またこれを利用して、ゼブラフィッシュ成体小脳では神経回路をリモデリングするため持続的にニューロンが産生されていること、を示しています。
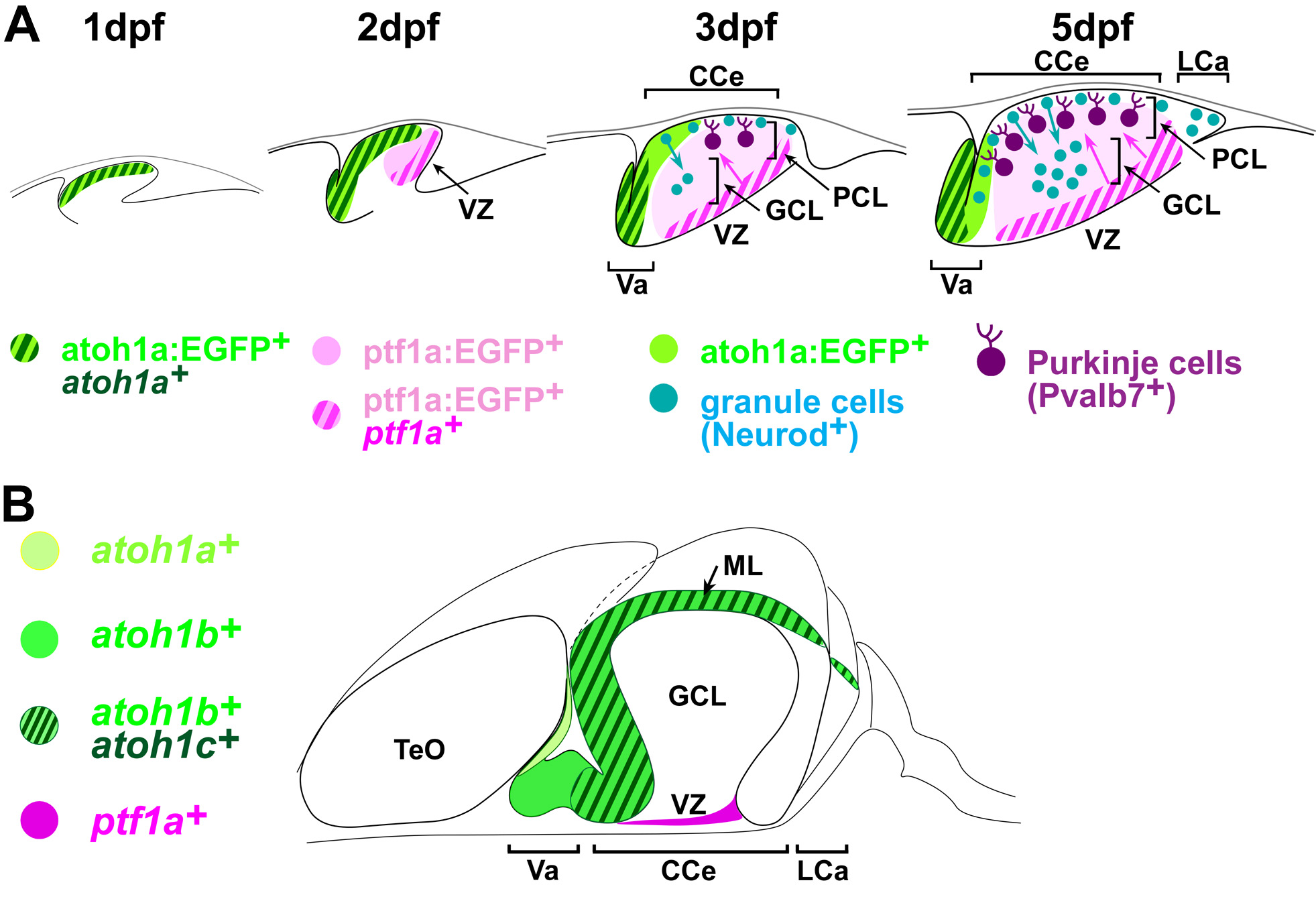
(A)ゼブラフィッシュにおける小脳ニューロンの発生。 受精後1日目(dpf)に、atoh1a陽性細胞が上菱脳唇に形成。 受精後2日目に、atoh1a陽性グルタミン酸作動性神経前駆細胞とptf1a陽性GABA作動性神経前駆細胞が、小脳原基の前半と後半部分を占めるようになる。 受精後3-5日の間に、atoh1a陽性細胞は分子層(ML)でNeurod1陽性の顆粒細胞に分化し、顆粒細胞層(GCL)に移動する。 一方この間に、ptf1a陽性細胞は脳室帯(VZ)から背側に移動し、プルキニエ細胞に分化するとともにプルキニエ細胞層(PCL)を形成する。 これらの過程を経て、受精後5日目には小脳三層構造が形成される。 (B)ゼブラフィッシュの成体におけるプロニューラル遺伝子の発現。 プロニューラル遺伝子の発現は、増殖神経前駆細胞で認められる。CCe:小脳体、LCa:小脳尾葉、TeO:視蓋、Va:小脳弁。
ゼブラフィッシュ小脳の解剖と小脳発生異常の変異体スクリーニング [Pubmed]
小脳は感覚情報と運動制御を統合処理する中枢神経組織である。小脳の組織構築の解析は、これまで主に哺乳類を用いて行われてきた。本論文では、ゼブラフィッシュの成体小脳のニューロンと神経回路を分子マーカーとトランスジェニックフィッシュを用いて記載した。小脳ニューロンは、GABA作動性とグルタミン酸作動性ニューロンに分けられる。GABA作動性神経であるプルキニエ細胞でありparvalbumin7等の特異的分子を発現する。一方グルタミン作動性神経は、vglut1陽性の顆粒細胞とvglut2強陽性のeurydendroid細胞(プルキニエ細胞の軸索を受ける;小脳核ニューロンに相当)からなる。eurydendroid細胞は、少なくともolig2陽性細胞とcalretinin抗体に反応する2種類の細胞から構成されることを見出した。小脳と同様に二つの入力情報を顆粒細胞とプルキニエ様細胞で処理するシステムは小脳様構造(内側聴側線核と中脳視蓋周縁層等)と呼ばれるが、小脳同様Parvalbumin7/Vglut1が発現する。小脳ニューロンの分化は受精後3日目から、層形成は受精後5日目から観察される。さらに、小脳ニューロン・神経突起形成に異常を示す変異体スクリーニングを行い、多数の変異体を単離した。これらのデータは、ゼブラフィッシュを用いた小脳ニューロン・神経回路形成研究の基盤を提供する。
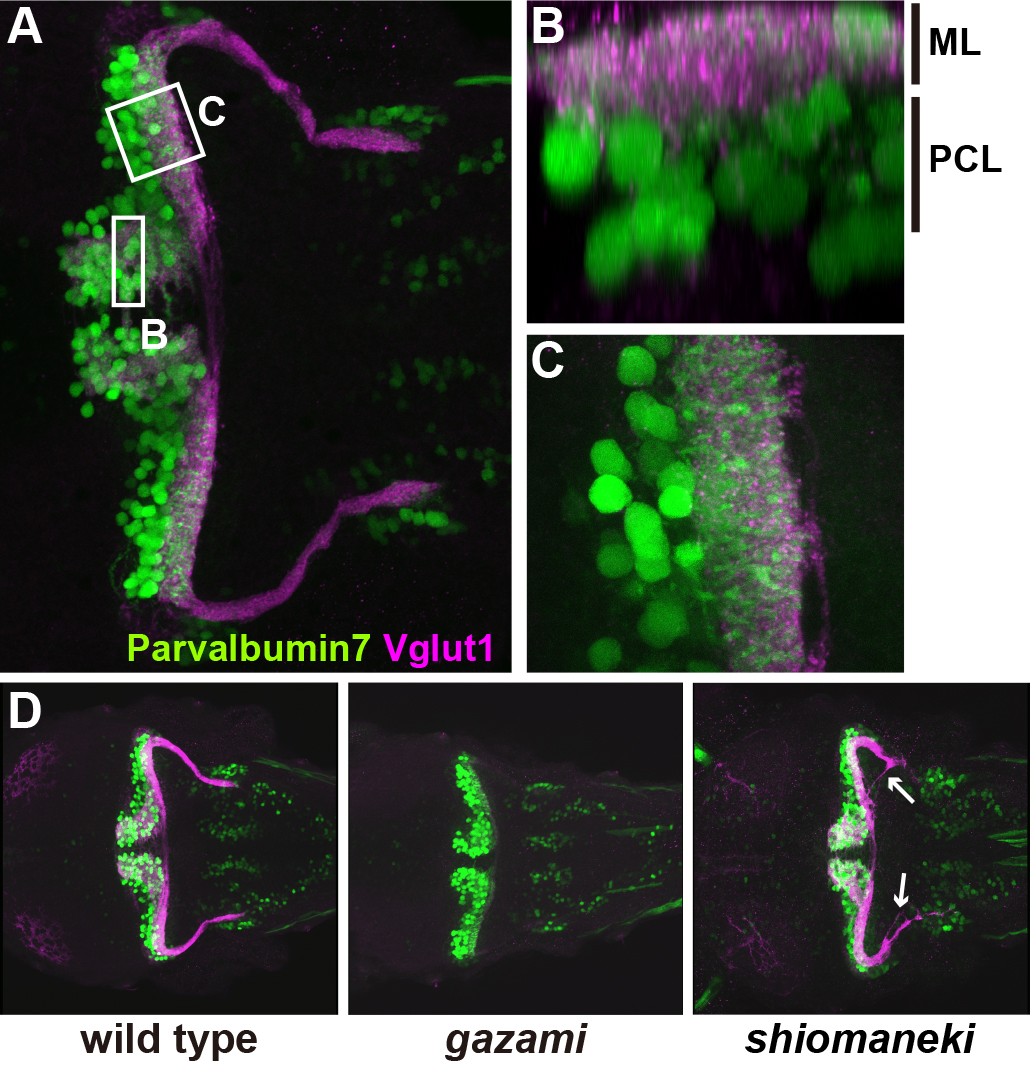
受精後5日目のゼブラフィッシュの小脳。(A-C)プルキンエ細胞を抗Parvalbumin7抗体で、顆粒細胞軸索を抗Vglut1z抗体で染色。背側像。領域Bの横断像(B)と領域Cの拡大像(C)。受精後5日目には、すでに分子層(ML)、プルキンエ細胞層(PCL)が認められる。 (D)野生型、gazami変異体、shimaneki変異体。gazami変異体は顆粒細胞軸索(平行線維)が欠損しており、shiomaneki変異体は顆粒細胞軸索の走行異常を示す(矢印)。