
高等植物は移動性をもたないことから、環境変動に対して様々な戦略によりその生存を確保している。植物は個体の成長に不適な環境条件に備えて、極度の環境耐性をもつ種子を形成し、成長に好適な環境が整うまで休眠することにより次世代の生存を確実なものにする。また、このようなライフサイクルによる適応に加えて、植物は個体の成長を脅かすような環境変動(環境ストレス)に対して巧妙かつ多彩な防御機構(環境ストレス耐性機構)を備えている。我々の農業生産は、このような植物の環境適応能力を利用し、またその弱点を克服することにより営まれている。当研究グループは、このような視点から、植物の種子形成ならび環境ストレス耐性機構に関する研究を進め、植物の生産能力の向上とさらなる開発の基盤育成に寄与することを目指している。
メンバー
スタッフ
教員
服部束穂(教授)
上口智治(准教授)
武田真(准教授)
西村泰介(客員准教授)
研究員
黒谷賢一(博士研究員)
米田弥生(博士研究員)
田代亨(客員研究者)
寺田理枝(客員研究者)
鈴木美穂(客員研究者)
大野裕介(客員研究者)
技術職員
加藤大和
学生・大学院生
戸田陽介(博士課程後期3年)、吉井正勝(博士課程前期1年)、堀佑太朗(博士課程前期1年)
鞍田京(博士課程前期1年)、小島栞(農学部4年生)、畑中彩希(農学部4年生)
中久木由佳(農学部4年生)、谷弘太(農学部4年生)
研究内容
- 種子形成と機能獲得の制御に関する研究(服部)
- 種子の主要部分は胚と胚乳である。前者は発芽後、植物体に成長し、後者は胚や幼植物の成長を支える栄養を蓄積する。また、イネの胚乳は人間の食料となるコメそのものでもある。私たちは、胚と胚乳の形成と機能獲得に関してそれぞれ異なる視点から研究を進めている。
- (i) 胚の形成と休眠・発芽
- 貯蔵物質の蓄積、乾燥耐性、成長停止・休眠といった胚の機能は、胚形成過程中期以降、共通の発生プログラムの支配下において獲得される。シロイヌナズナでは、胚形成プログラムを支配するマスターレギュレータ遺伝子としてABI3、FUS3、LEC1およびLEC2が同定されており、何れも転写因子をコードする(図1)。これまで私たちは、これらの転写因子の機能を中心に種子成熟過程における転写制御ネットワークを解析してきた。また、これらの制御遺伝子の機能喪失変異体では、種子を特徴づける性質の欠損とともに、発芽後の遺伝子発現プログラムが胚発生過程で異時発現する。すなわち、これらの制御因子は、発芽後プログラムの発現抑制という機能も担っている(図1)。このような変異体における異時発現現象は、種子の休眠と発芽に深く関係するため、種子形成から発芽後成長への遺伝子プログラム変換という視点から休眠発芽現象を理解しようとする研究も進めている。これまでに、発芽後遺伝子プログラムが種子形成過程で誤発現する変異体を新たに多数単離し解析をおこなっている。さらに関連して、不十分な休眠によって引き起こされ、農業上の被害ともなる「穂発芽」を抑制するための遺伝子操作研究も行っている。
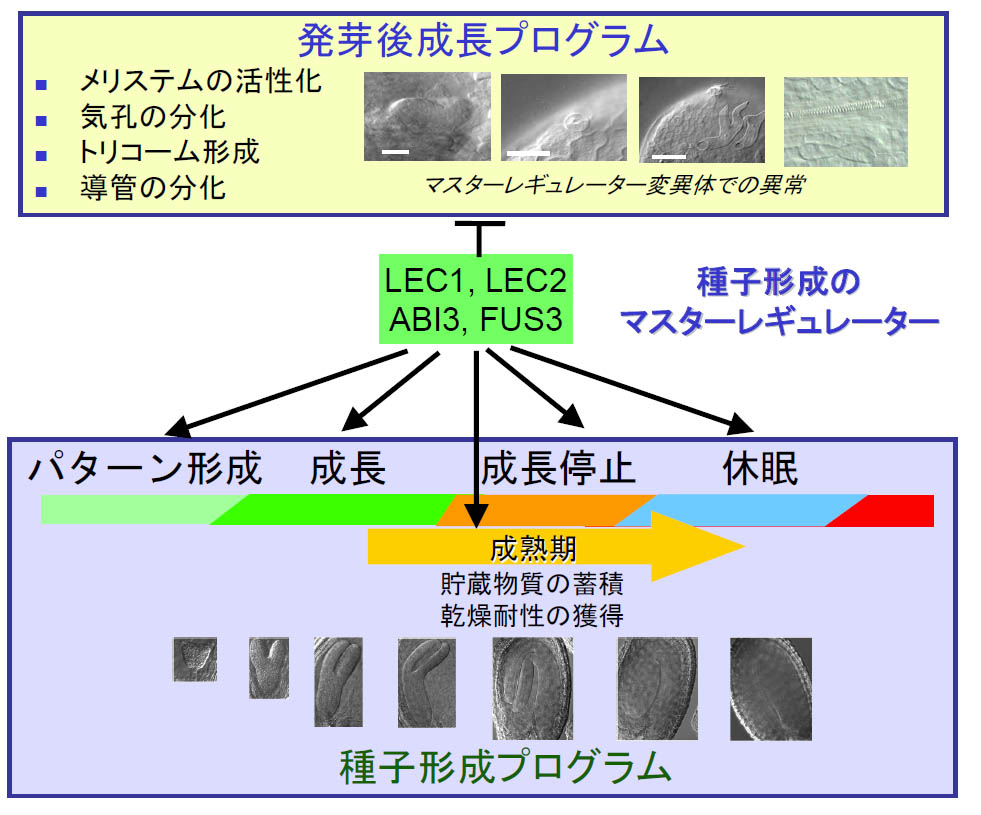
- 図1 種子形成マスターレギュレータ遺伝子、LEC1, LEC2, FUS3 およびABI3による種子形成プログラムの正の制御と発芽後プログラムの負の制御。
- (ii) 胚乳初期発生の制御機構に関する研究
胚乳は、重複受精によって形成される3n核が細胞質分裂を行わずに分裂を繰り返した後、区画化が起きて胚乳細胞が誕生し、さらに細胞分裂を繰り返すことにより形成される。しかし、このような特殊な組織形成過程の分子メカニズムはほとんど明らかにされていない。私たちは、胚乳が形成されないイネの変異体endospermless1(enl1)の性質を調べるとともに、その原因遺伝子も突き止めた。enl1変異体では、胚乳核の分裂が正常に起こらず、不定形な巨大な核を生じていた。ENL1遺伝子は、高等真核生物において広く保存されたSNF1ヘリカーゼ様タンパク質をコードし、そのヒトオルソログPICHは複製した染色体の分離において重要な役割を果たしている。このようなENL1の遺伝子機能を足がかりにするとともに、新たに同定した無胚乳変異体の解析を進めることよりイネの胚乳初期発生の分子機構を明らかにしようとしている。 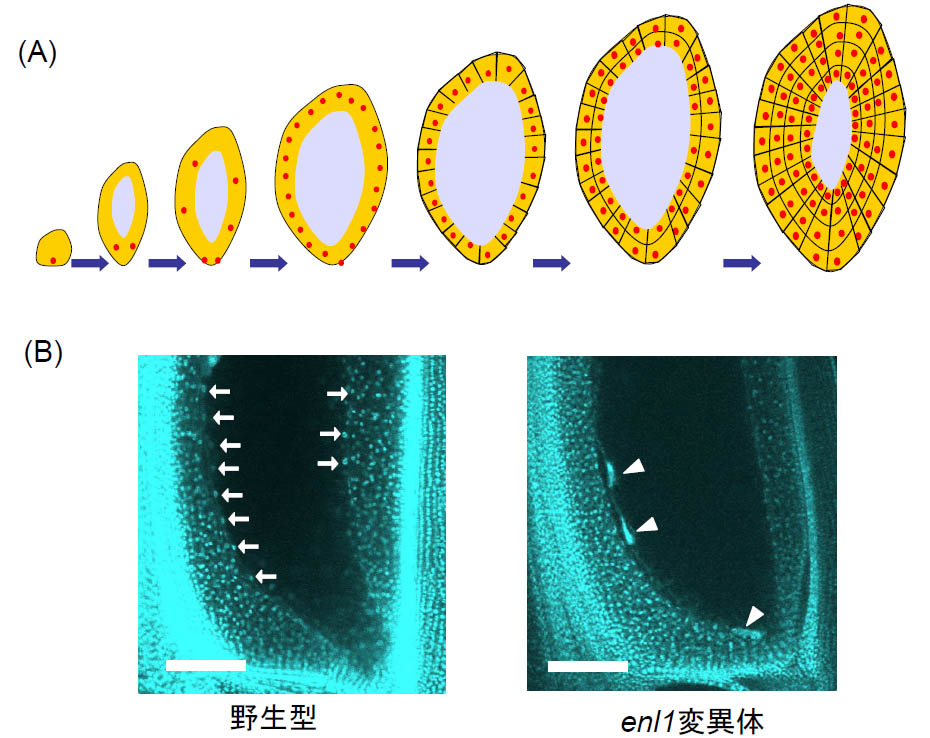
- 図2 穀類の胚乳発生の概略(A)とイネ無胚乳変異体enl1の核分裂異常。
(A) 重複受精により生じた3nの胚乳核(赤丸)は細胞質分裂を伴わずに分裂増殖し、中央細胞の中央液胞(水色)の周囲に並ぶ。その後、細胞の区画化(細胞化)が起こり、ついで通常の細胞分裂により胚乳細胞が増殖し胚乳組織が形成される。
(B) 野生型は、多数の胚乳核が中央液胞の周囲に整列する(矢印)が、enl1変異体においては、少数の巨大な核(矢頭)が観察される。
-
- ストレス環境条件下において植物の生長・生存を維持する仕組みの研究 (武田・服部)
- ストレス環境下におかれた際に、植物が生育を維持するためには、メリステムと呼ばれる組織の活性を維持することが重要である。メリステムの機能維持には、細胞の分裂が分化と協調して起きる必要があるが、細胞の分裂活性がストレス環境条件下でどのように維持されるかについては、これまで殆ど理解されていない。
私たちは、分子遺伝学的な解析から、イネのRSS1因子がストレス環境下での細胞増殖に必要な因子であることを見出している。RSS1の機能が欠損したイネ変異体rice salt sensitive 1 (rss1)は、通常の生育条件下では野生型と同様に生育するが、塩ストレス存在下では顕著な生育阻害を呈する(図3)。このときのrss1変異体の地上部の分裂組織を調べると、細胞分裂時に発現する多くの遺伝子の発現量が野生型よりも低下しており、また、細胞周期のS期やG2-M期に特異的な発現を示す遺伝子の発現する組織が縮小し、発現する細胞の数も減少していた(図4)。これら2つの細胞周期マーカー遺伝子の発現する細胞が、いずれも変異体で減少することから、RSS1はG1期からS期への移行に重要な役割をもつと考えられる。さらにまた、RSS1がタンパク質脱リン酸化酵素(PP1)の触媒サブユニットと結合することなどから、RSS1は何らかの調節タンパク質のリン酸化状態の制御を介して、ストレス環境下での細胞の分裂活性を維持するものと推定されている。こうした仕組みの理解をするとともに、ストレス環境下での細胞分裂と細胞分化とのバランスがどのように維持されているか、また個体生存がどのような因子により支えられているかを明らかにすることを目指している。 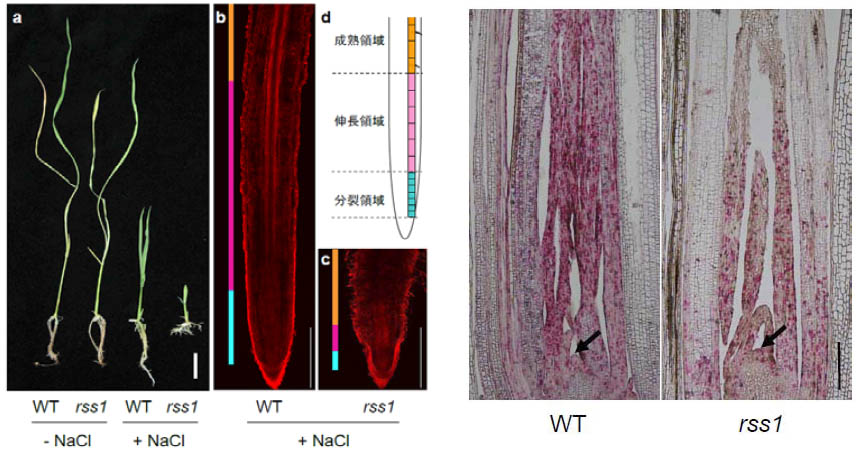
- 図3(左) rss1変異体は、高い塩ストレス感受性を示す。(a) 150 mM NaClを含む、または含まない培地で育てた野生型(WT)とrss1変異体。(b,c)150 mM NaClを含む培地で育てたWTとrss1変異体の種子根の先端部。蛍光色素で染色し、共焦点レーザー顕微鏡を用いて観察。(d)根端領域の模式図。
- 図4(右 150 mM NaClを含む培地で育てた野生型(WT)とrss1変異体の地上部の基部組織における細胞周期マーカー遺伝子の発現。S期で特異的に発現するHistone H4遺伝子(赤色)、G2期からM期にかけて特異的に発現するCyclin B2遺伝子(紫色)の発現をin situ ハイブリダイゼーション法によって検出。矢印:頂芽メリステムの位置。
- 遺伝子のエピジェネティックな発現制御に関わる研究(武田)
- 染色体がもつ遺伝情報には、DNA塩基配列のもつ情報と、クロマチン構造にリンクしたエピジェネティックな情報の2つがある。近年、ストレス応答や発生・成長制御におけるエピジェネティック情報の重要性が強く認識されるようになってきた。細胞機能の発現に重要な役割を果たす配列情報とエピジェネティック情報は、ともに細胞分裂時に娘細胞に伝えられるが、前者の複製・伝達機構の解明が進んでいるのに対し、エピジェネティックな情報をもったクロマチンの複製機構については未解明の点が多い。当研究グループでは、これらの2つの情報の維持に重要な核内因子BRU1の解析を進めるとともに、細胞の分化状態が変化する際に、どのようなエピジェネティック情報の変換が起こるかを理解しようとしている。
- メリステムの機能維持機構に関する研究(上口)
- シロイヌナズナにおいて頂端分裂組織の機能維持に関与する二つの遺伝子(BOQとMDO1)についての研究を行った。詳細な解析から、BOQタンパク質は、茎頂分裂組織SAMの未分化細胞から生じた娘細胞が分化運命決定を受けて器官形成を行う間、分化運命を維持する機能を持つことを明らかにした(図5)。また、mdo1変異体の解析から、変異体細胞ではDNA損傷レベルが恒常的に上昇し、この傷害に特に弱い幹細胞の分化や細胞死が頻繁に生じていることを見出し、この遺伝子がDNAを保護する役割を持っていることを明らかにした(図2)。MDO1遺伝子は陸上植物のみに広く保存されている遺伝子で、水中に比べてDNA損傷が起こりやすい陸上環境に適応するために獲得された進化上大変重要な遺伝子であると考えている。
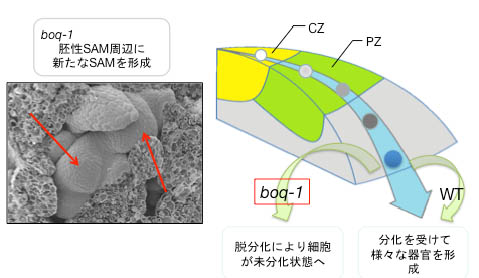
- 図5.BOQは分化過程に入った細胞の運命維持に関わる。
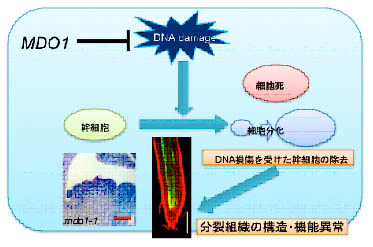
- 図6.MDO1はDNA損傷レベルを下げることで幹細胞の維持に関わる。
- またmdo1変異体の次世代種子の表現型解析から、花器官において体細胞系列から生殖細胞系列に移行して配偶子を形成する過程で、配偶子ゲノムの品質管理に関わる新規メカニズムが働いているという興味深い現象を発見した。mdo1変異体の次世代種子は受精までの過程は正常に進行するものの、初期胚発生に異常をきたし、発芽可能な胚を形成できない。胚発生可能であるのは、雌雄いずれかの配偶子が由来する片親が野生型表現型を示すことが十分条件となっていた。配偶子ゲノムが健全であることは種の継続性にとってきわめて重要であり、mdo1変異体のようにDNA損傷レベルが昂進してゲノムの健全性が損なわれている可能性が高い場合、配偶子自体に胚発生可能な能力を付与しないことは生物学的にも合理的であると考えられる(図7)。
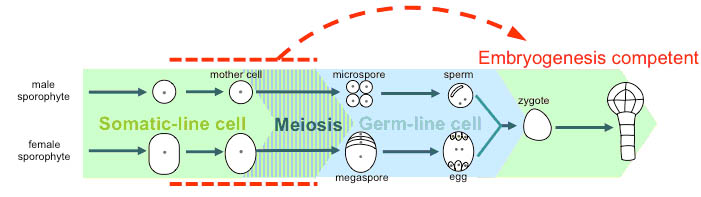
- 図7.胚発生可能な配偶子形成メカニズム
主要な論文
- II. 研究報告 (主要な報文のみを記載)
植物のストレス応答・耐性機構および種子成熟に関する論文、総説
1. Kobayashi, Y., Yamamoto, S., Minami, H., Kagaya, Y. and Hattori, T. (2004) Differential activation of the rice SnRK2 protein kinase family by hyperosmotic stress and abscisic acid. Plant Cell, 16, 1163-1177.
2. Kagaya, Y., Toyoshima, R., Okuda, R., Ban A., Usui, H., Yamamoto, A. and Hattori, T. (2005) LEAFY COTYLEDON1 controls seed storage protein genes through its regulation of FUSCA3 and ABSCISIC ACID INSENSITIVE3. Plant Cell Physiol., 46, 399-406.
3. Kobayashi, Y., Murata, M., Minami, H., Yamamoto, S., Kagaya, Y., Hobo, T., Yamamoto, A., and Hattori, T. (2005) Abscisic acid-activated SNRK2 protein kinases function in the gene-regulation pathway of ABA signal transduction by phosphorylating ABA response element-binding factors. Plant J., 44, 939-949.
4. Takeda, S. and Matsuoka, M. (2008) Genetic approaches to crop improvement: responding to environmental and population changes. Nature Rev. Genet., 9, 444-457.
5. 服部束穂 (2008) 種子貯蔵タンパク質遺伝子の制御ネットワーク.「種子の科学とバイオテクノロジー」種子生理生化学研究会編、原田久也監修 学会出版センター pp. 127-130 - 6. Yamamoto, A., Kagaya, Y., Toyoshima, R., Kagaya, M., Takeda, S. and
Hattori, T. (2009) Arabidopsis NF-YB subunits LEC1 and LEC1-LIKE activate
transcription by interacting with seed-specific ABRE-binding factors. Plant
J., 58, 843–856.
7. Kagaya, Y. and Hattori, T. (2009) Arabidopsis transcription factors, RAV1 and RAV2, are regulated by touch-related stimuli in a dose-dependent and biphasic manner. Genes Genet Syst., 84, 95-99.
8. Sugimoto, K., Takeuchi, Y., Ebana, K., Miyao, A., Hirochika, H., Hara, N., Ishiyama, K., Kobayashi, M., Ban, Y., Hattor,i T. and Yano, M. (2010) Molecular cloning of Sdr4, a regulator involved in seed dormancy and domestication of rice. Proc. Natl. Acad. Sci. USA., 107, 5792-5797.
9. Yamamoto, A., Kagaya, Y., Usui, H., Hobo, T, Takeda, S. and Hattori, T. (2010) Diverse roles and mechanisms of gene regulation by the Arabidopsis seed maturation master regulator FUS3 revealed by microarray analysis. Plant Cell Physiol. 51, 2031-2046.
10. Brini, F. Yamamoto, A., Jlaeil, L., Takeda, S., Hobo, T., Dinh, H.Q., Hattori, T., Masmoudi, K. and Hanin, M. (2011) Pleiotropic effects of the wheat dehydrin DHN-5 on stress responses in Arabidopsis. Plant Cell Physiol., 52, 676-688.
11. Ogawa, D., Abe, K., Miyao, A., Kojima, M., Sakakibara, H., Mizutani, M. Morita, H., Toda, Y. Hobo, T. Sato, Y., Hattori, T., Hirochika, H. and Takeda, S. (2011) RSS1 regulates the cell cycle and maintains meristematic activity under stress conditions in rice. Nature Communications, 2, 278. - 12. 西村宣之、服部束穂 (2010) 解明が進むアブシジン酸受容体とシグナル伝達メカニズム. 植物の生長調節45, 140-143.
- 13. Hanin, M., Brini, F., Ebel, C., Toda, Y., Takeda, S. and Masmoudi, K. (2011) Plant dehydrins and stress tolerance: versatile proteins for complex mechanisms." Plant Signaling & Behavior. 6, 1503-1509.
エピジェネティックな遺伝子発現制御に関する論文、総説
1. Takeda, S., Tadele, Z., Hofmann, I., Probst, A.V., Angelis, K.J., Kaya, H., Araki, T., Mengiste, T., Mittelsten Scheid, O., Shibahara, K., Scheel, D. and Paszkowski, J. (2004) BRU1, a novel link between responses to DNA damage and epigenetic gene silencing in Arabidopsis. Genes & Dev., 18, 782-793.
2. Takeda, S. and Paszkowski, J. (2006) DNA methylation and epigenetic inheritance during plant gametogenesis. Chromosoma, 115, 27-35.
3. Ono, T., Kaya H., Takeda, S., Abe, M., Ogawa, Y., Kato, M., Kakutani, T., Mittelsten Scheid, O., Araki, T. and Shibahara, K. (2006) Chromatin assembly factor 1 ensures the stable maintenance of silent chromatin states in Arabidopsis. Genes Cells, 11, 153-162.
4. Ohno, Y., Narangajavana, J., Yamamoto, A., Hattori, T., Kagaya,Y., Paszkowski, J., Gruissem,W., Hennig, L., and Takeda, S. (2011) Ectopic gene expression and organogenesis in Arabidopsis mutants missing BRU1 required for genome maintenance." Genetics. 189; 83-95.- メリステムの機能と制御に関する論文,総説
- 1. 上口智治(2002)二成分制御系。「植物の形づくり」蛋白質 核酸 酵素 47, 1711-1716.
2. Takeda T., Suwa Y., Suzuki M., Kitano H., Ueguchi-Tanaka M., Ashikari M., Matsuoka M. and Ueguchi C. (2003) The OsTB1 gene negatively regulates lateral branching in rice. Plant J., 33, 513-520.
3. Nishimura C., Ohashi Y., Sato S., Kato T., Tabata S. and Ueguchi C. (2004) Histidine kinase homologs that act as cytokinin receptors possess overlapping functions in the regulation of shoot and root growth in Arabidopsis. Plant Cell, 16, 1365-1377.
4. 上口智治(2004)サイトカイニンシグナル伝達の分子機構と生物学的機能。蛋白質 核酸 酵素 49, 2549-2557.
5. Kuroha T., Ueguchi C., Sakakibara H. and Satoh S. (2006) Cytokinin receptors are required for normal development of auxin-transporting vascular tissues in the hypocotyl but not in adventitious roots. Plant Cell Physiol. 47, 234-243.
6. Takeda, T., Amano, K., Ohto, M., Nakamura, K., Sato, S., Tabata, S. and Ueguchi, C. (2006) RNA interference of the Arabidopsis putative transcription factor TCP16 gene results in abortion of early pollen development. Plant Mol. Biol., 61, 165-177.
7. Hashimura, Y. , and Ueguchi, C. (2011) The Arabidopsis MERISTEM DIOORGANIZATION 1 gene is required for the maintenance of stem cells through the reduction of DNA damage. Plant J., 68, 657-669.
連絡先
服部束穂 hattori(at)agr.nagoya-u.ac.jp
上口智治 cueguchi(at)agr.nagoya-u.ac.jp
武田 真 takeda(at)agr.nagoya-u.ac.jp
(at)を@に換えて下さい。
所在地
住所
〒464-8601名古屋市千種区不老町
名古屋大学生物機能開発量研究センター
ただし、当研究分野やセンター建物とは別の場所にあります(理農館1F)
キャンパスマップ(リンク)のD2⑥の建物です。